機能性表示食品の新基準「PRISMA2020」で何が変わった?企業の約7割が審査や差し戻しに不安を感じている実態が明らかに!
近年、食品やサプリメントの「安全性」や「科学的根拠」に対する注目が高まっています。特に機能性表示食品制度においては、エビデンスの透明性向上を目指し、「PRISMA 2020声明(PRISMA2020)」に準拠したシステマティック・レビュー(SR)の作成が求められるようになりました。2025年4月以降は、この新基準での届け出が必須となります。
企業では新たな対応が進められていますが、現状どのような課題があるのでしょうか?株式会社EASが、消費者庁への機能性表示食品に関する届け出を担当する品質管理の代表者・担当者を対象に実施した調査結果を見ていきましょう。
PRISMA2020への企業の対応状況
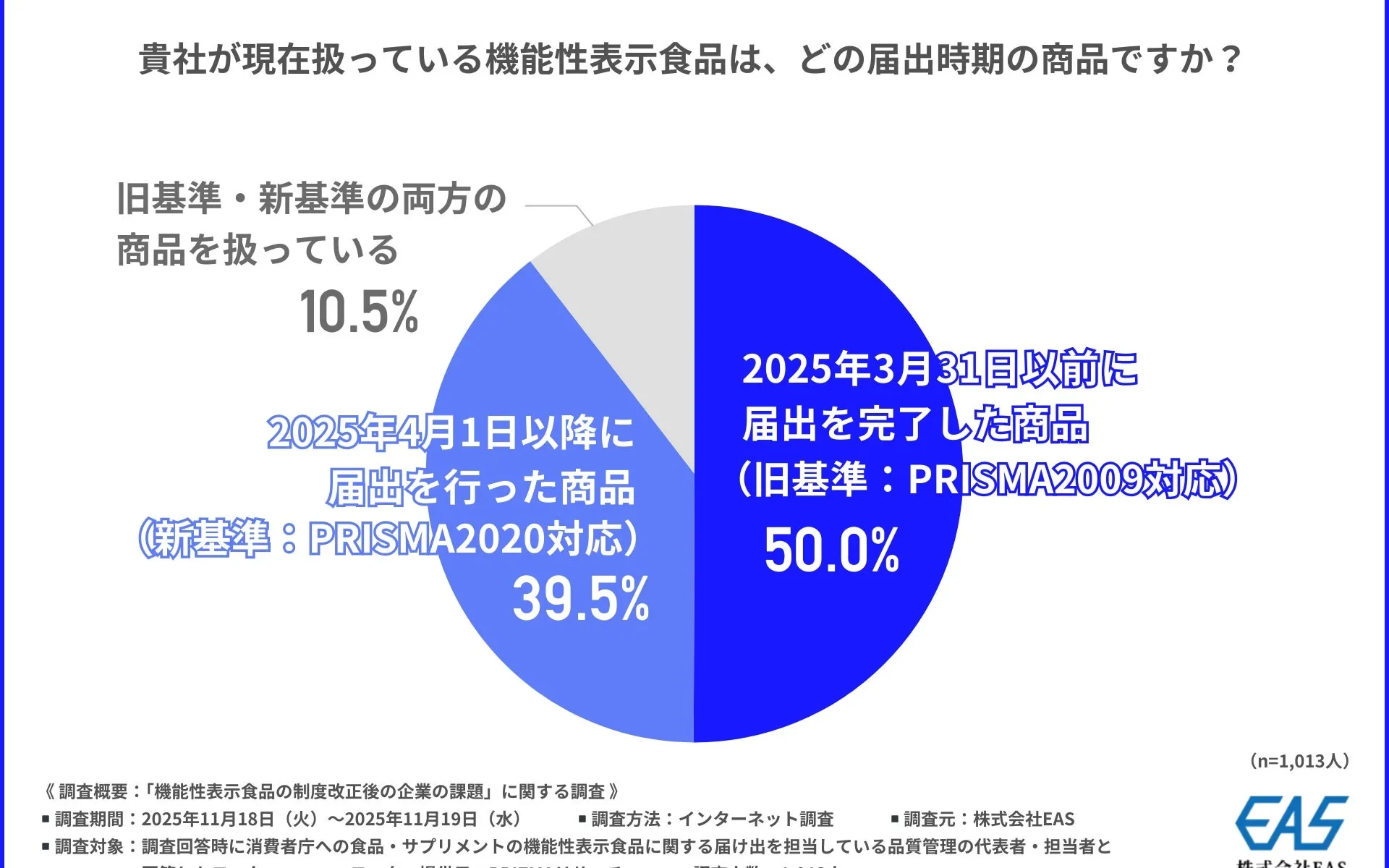
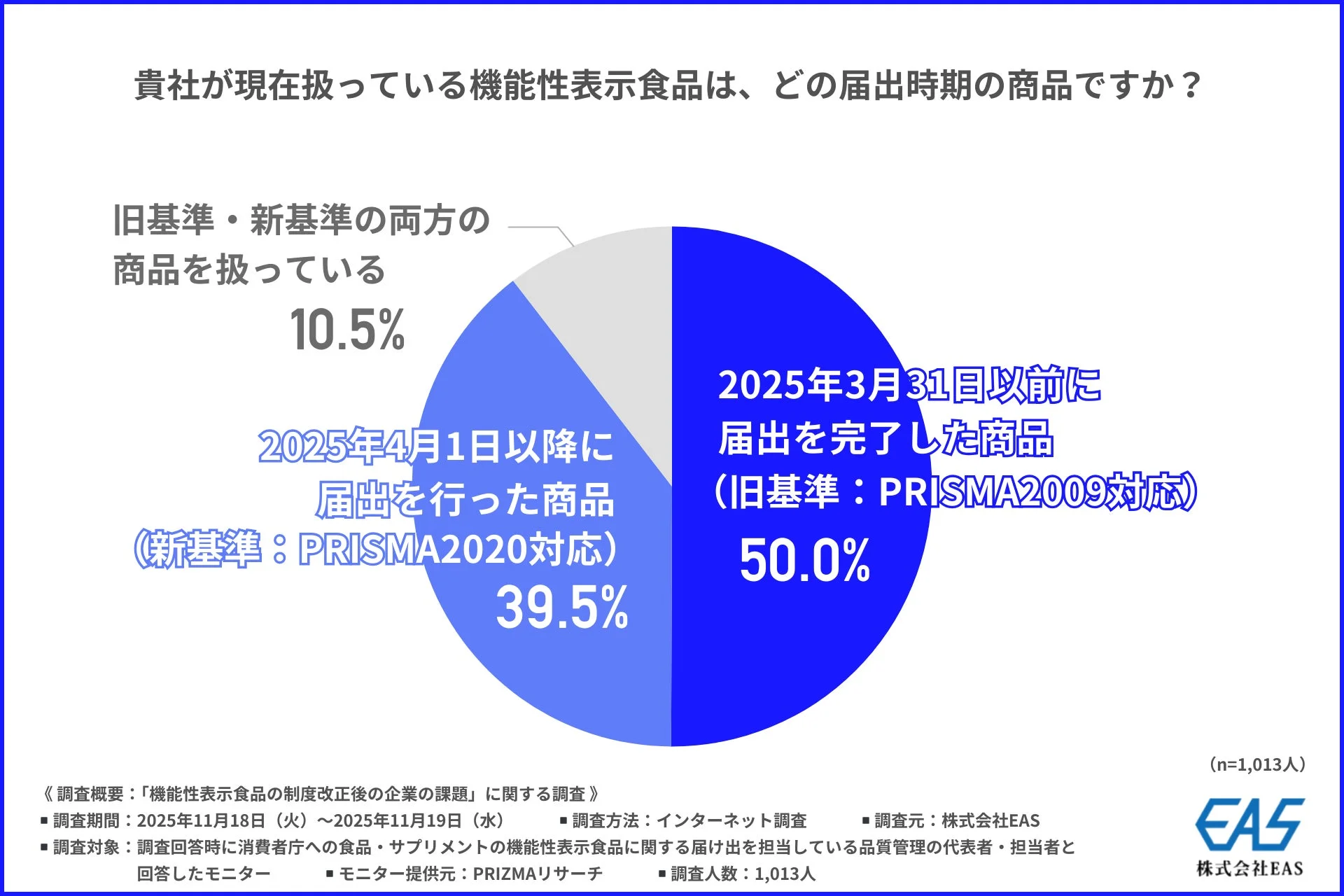
まず、「現在扱っている機能性表示食品の届出時期」について尋ねたところ、「2025年3月31日以前に届出を完了した商品(旧基準:PRISMA2009対応)」が50.0%を占める一方で、「2025年4月1日以降に届出を行った商品(新基準:PRISMA2020対応)」も約4割(39.5%)に上りました。旧基準と新基準の両方を扱っている企業も10.5%あり、新基準への移行が進んでいることがうかがえます。
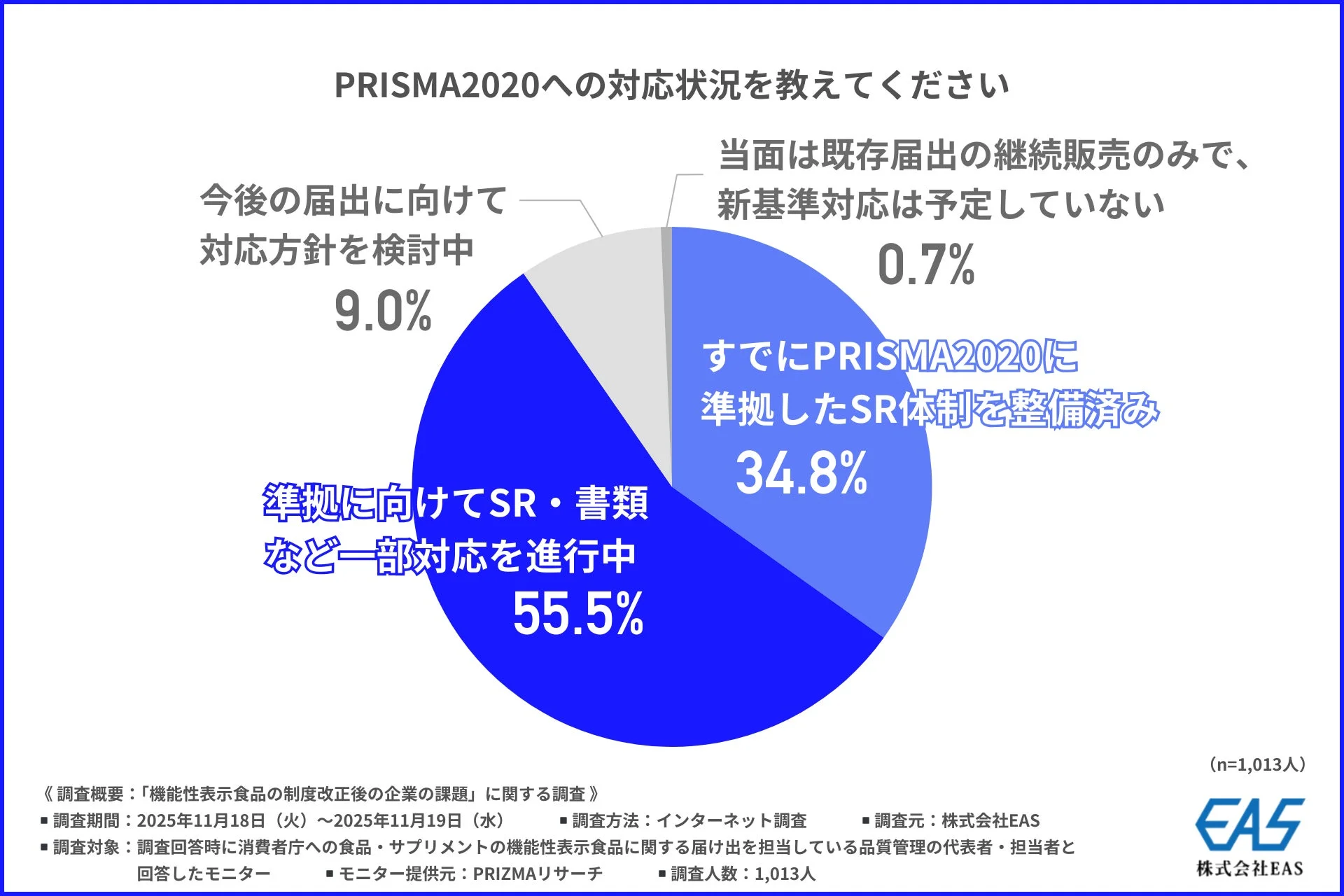
次に、「PRISMA2020への対応状況」を尋ねると、「すでにPRISMA2020に準拠したSR体制を整備済み」と回答した企業は34.8%、「準拠に向けてSR・書類など一部対応を進行中」が55.5%でした。これらを合わせると約9割の企業が新基準への対応を進めていることがわかります。
また、PRISMA2020の「義務対応(届出時に必須の対応)」と「任意対応(努力義務・今後求められる対応)」の区別については、約9割の担当者がおおむね区別できていると回答しており、約半数は「明確に区別できている(社内ガイドラインあり)」と答えました。これは、担当者がPRISMA2020対応を重要視している証拠と言えるでしょう。
審査・差し戻しへの不安と具体的な課題
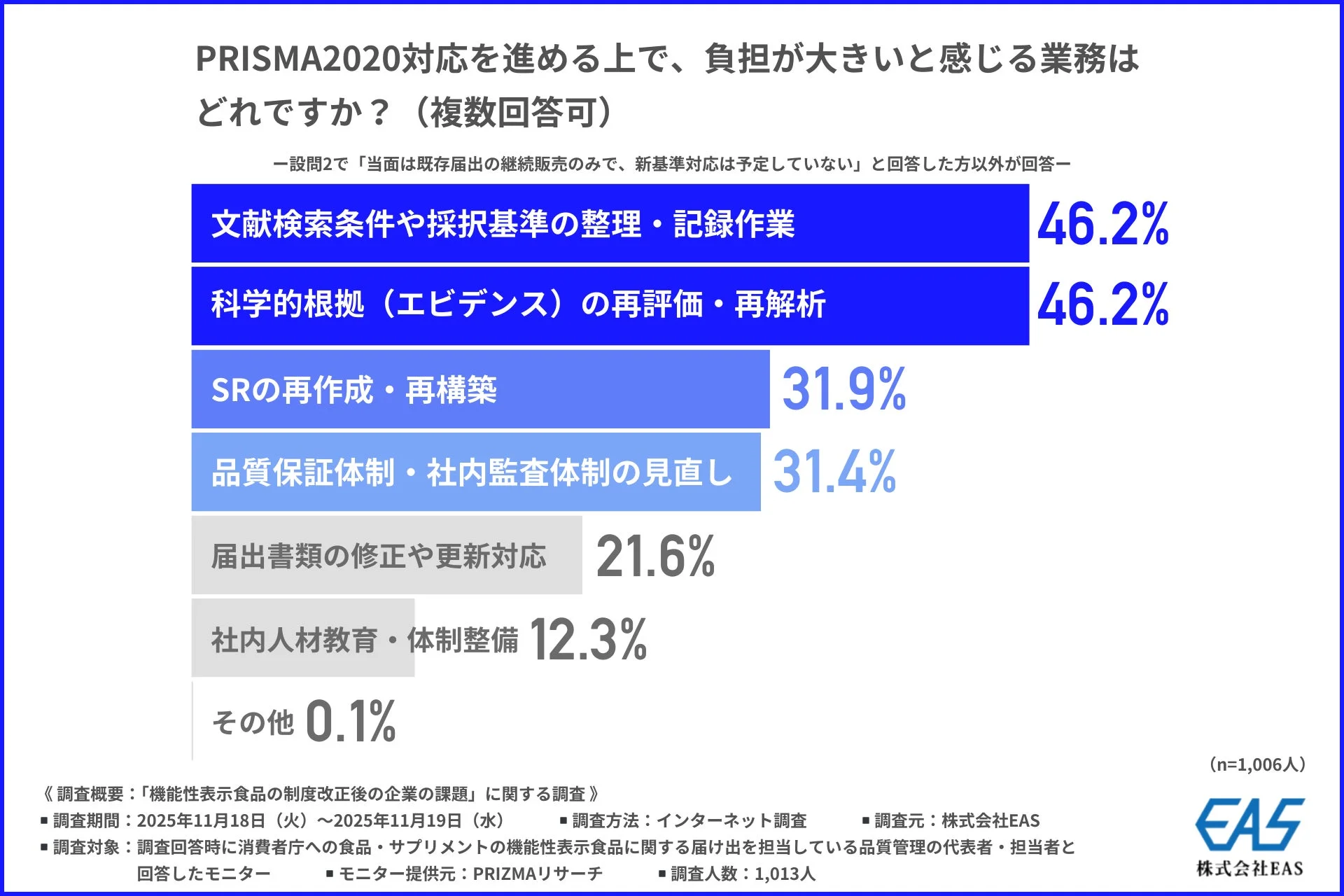
PRISMA2020対応を進める上で「負担が大きいと感じる業務」としては、「文献検索条件や採択基準の整理・記録作業」と「科学的根拠(エビデンス)の再評価・再解析」が同率で46.2%と最も多く挙げられました。これらはSRの根幹をなす基礎的かつ手作業の多い業務であり、精度と網羅性が求められるため、大きな負担となっているようです。
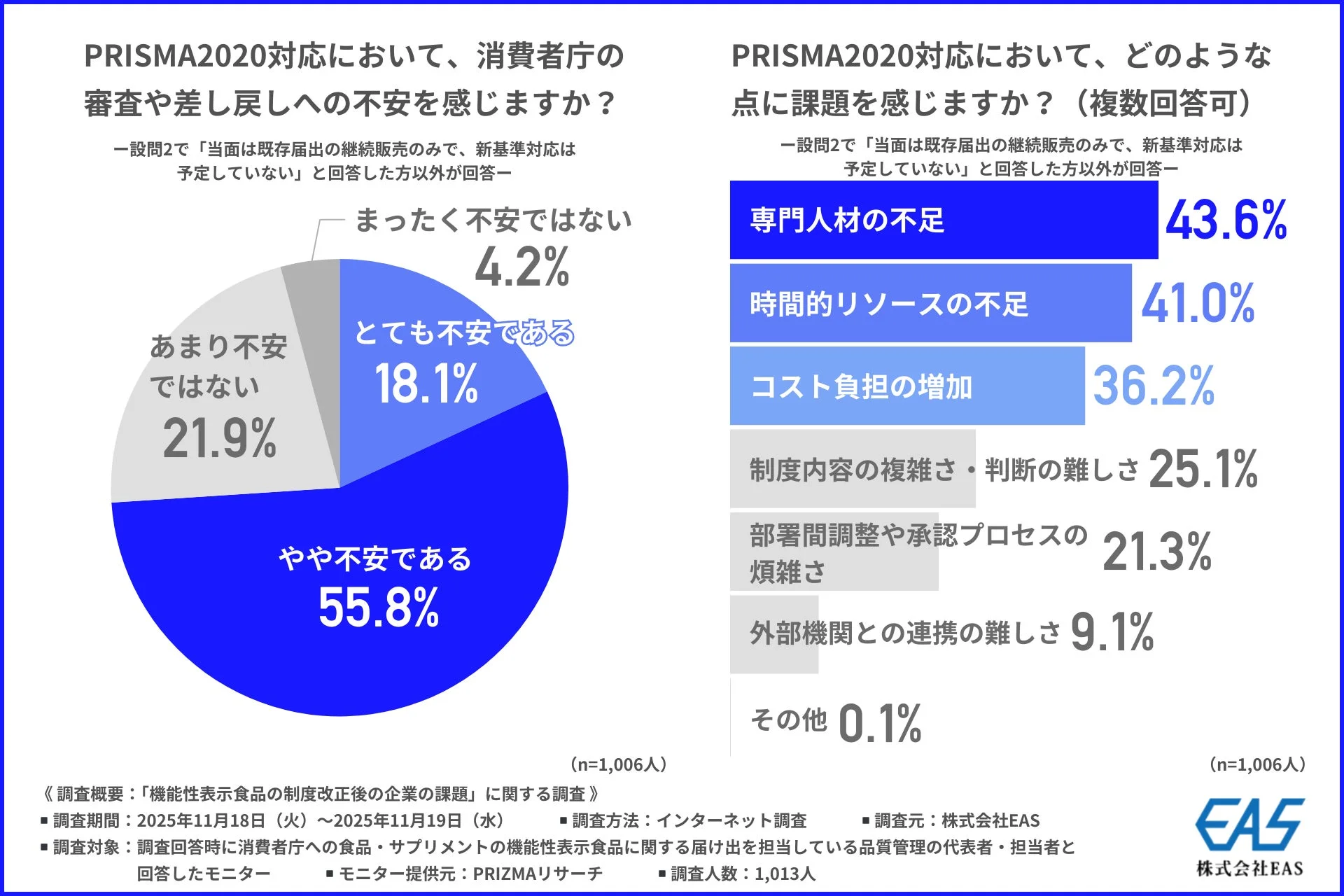
さらに、「PRISMA2020対応において、消費者庁の審査や差し戻しへの不安を感じるか」という質問には、約7割の企業が「とても不安である」(18.1%)または「やや不安である」(55.8%)と回答しました。新基準への移行に伴う要件の厳格化や解釈の難しさが、この不安の背景にあると考えられます。
感じる課題としては、「専門人材の不足」(43.6%)が最も多く、「時間的リソースの不足」(41.0%)、「コスト負担の増加」(36.2%)が続きました。要件の厳格化により、詳細で専門的な知識や作業が求められるようになり、対応可能な人材が限られ、時間やコストも増えていることがうかがえます。
外部支援機関の活用がカギに
これらの課題を解決するため、企業は今後どの領域を強化したいと考えているのでしょうか。「品質保証・体制の強化」(46.2%)が最も多く、次に「外部支援機関との連携」(40.6%)、「社内教育・マニュアル整備」(33.9%)が続きました。科学的根拠の信頼性確保や透明性向上のためには、厳格な品質管理体制が不可欠であり、専門知識の共有や組織全体の対応力向上が重視されているようです。
実際に外部支援機関を活用しているか尋ねたところ、9割以上が「すでに活用している」(45.8%)または「現在検討中」(50.3%)と回答しました。この結果から、専門性の高いPRISMA2020対応を自社だけで完結させるのは難しいと多くの企業が考えていることがわかります。
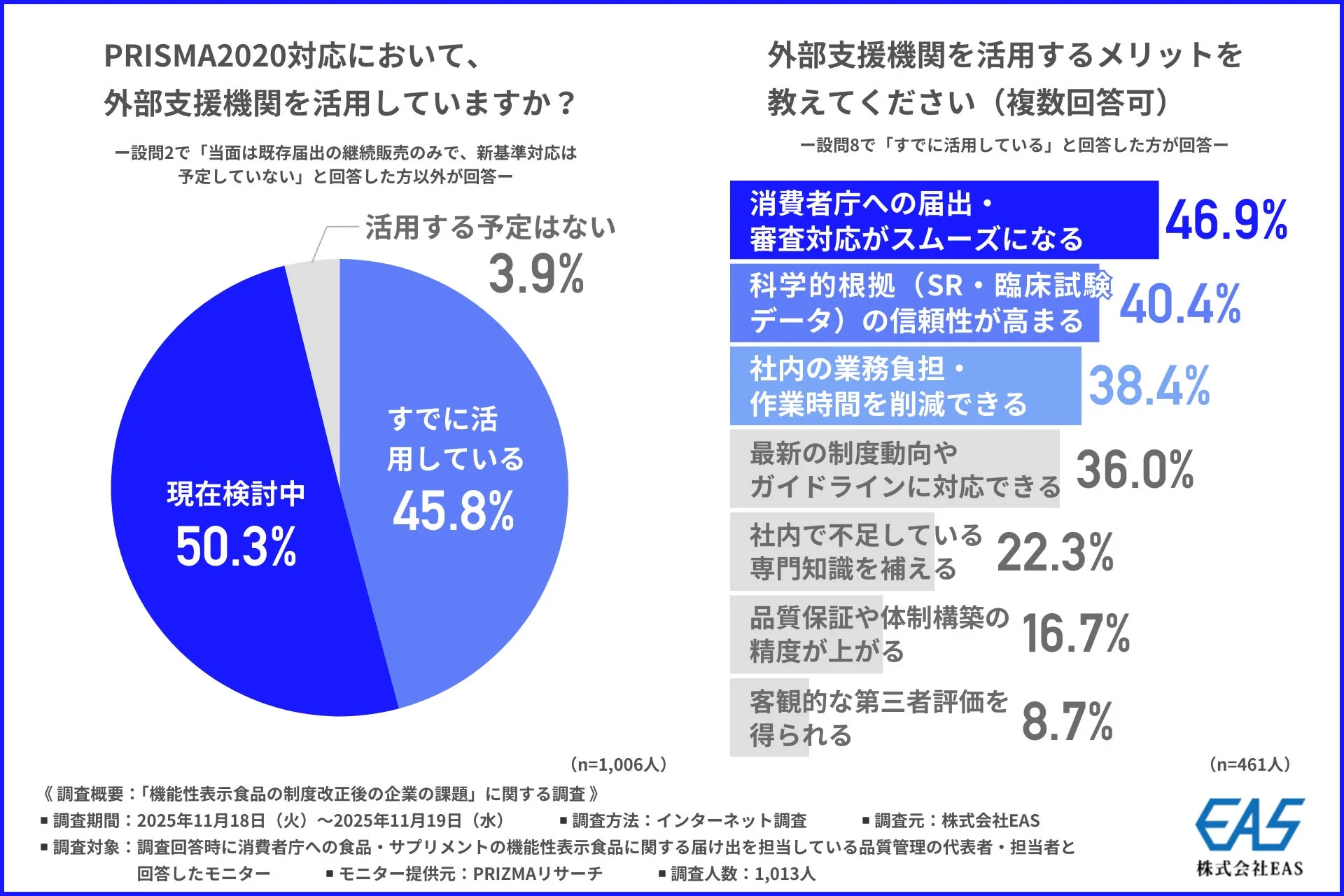
外部支援機関を活用するメリットとしては、「消費者庁への届出・審査対応がスムーズになる」(46.9%)が最も多く挙げられました。多くの企業が審査や差し戻しに不安を感じているため、その対応を任せられることに大きなメリットを感じているようです。「科学的根拠(SR・臨床試験データ)の信頼性が高まる」(40.4%)や「社内の業務負担・作業時間を削減できる」(38.4%)も上位に挙がり、品質と効率の両面で強化が期待されています。
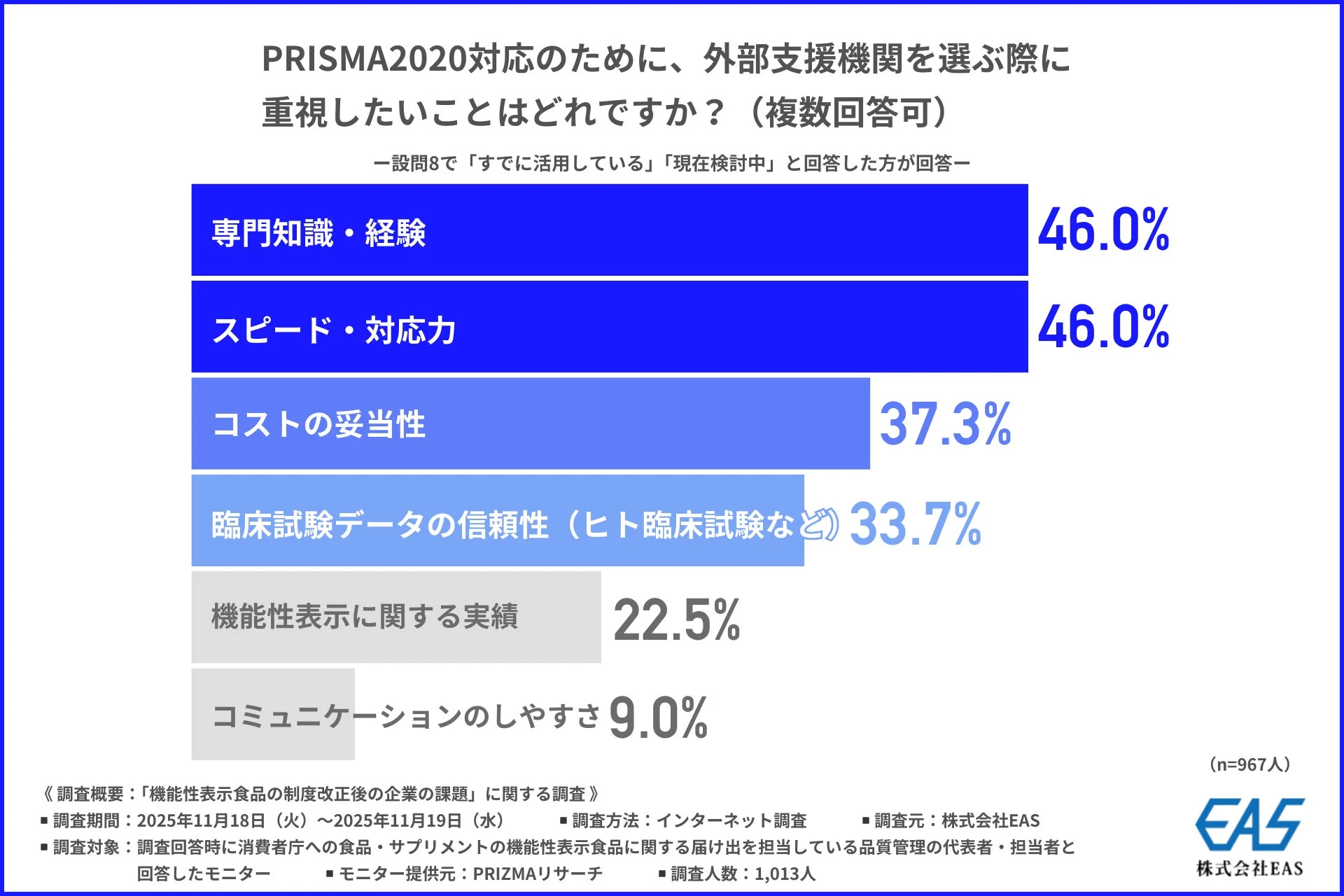
外部支援機関を選ぶ際に重視したいこととしては、「専門知識・経験」と「スピード・対応力」が同率1位(46.0%)でした。PRISMA2020対応には高度な判断と迅速な作業が求められるため、これらの点が重要視されていると言えるでしょう。また、「コストの妥当性」(37.3%)や「臨床試験データの信頼性」(33.7%)も重視されており、専門性、効率、コストのバランスを見極めて選定したいという企業の意向がうかがえます。
まとめ:企業が直面する“専門性の壁”と外部支援の必要性
今回の調査で、機能性表示食品の制度改正「PRISMA2020」への対応において、企業が「専門人材・時間的リソースの不足」や「コスト負担の増加」といった課題に直面していることが明らかになりました。
特に「文献検索条件や採択基準の整理・記録作業」、「科学的根拠の再評価・再解析」といった業務に大きな負担を感じており、消費者庁の審査や差し戻しへの不安も大きいようです。そのため、多くの企業が外部支援機関の活用を検討・実施しており、「専門知識・経験」と「スピード・対応力」を重視して選定しています。
PRISMA2020対応は「専門性」と「信頼性」がカギとなります。高度な専門性を必要とする領域を適切に支え、確かな科学的根拠とスピード感をもって支援できる外部支援機関の存在は、今後ますます重要になるでしょう。
ヒト臨床試験・試験データ受託機関なら「株式会社EAS」
今回の調査を実施した株式会社EASは、機能性表示食品やサプリメントなどの製品のエビデンス構築を支援するヒト臨床試験・試験データの受託機関です。

EASは、製品の機能性・安全性を科学的に証明するためのヒト臨床試験(RCT/オープン試験)や各種データ取得サービスをワンストップで提供しています。食品・サプリメント・化粧品・健康素材など、消費者向け製品の「確かな根拠づくり」が求められる場面で、信頼性の高いエビデンスを取得することが可能です。
これまでの臨床試験事業を通じて、多数の医療機関、大学・研究機関、治験スペシャリストとのネットワークを構築しており、案件ごとに適切な第三者機関をアサインし、試験デザイン策定からレポート作成までを一貫してサポートしてくれます。
EASは、企業が国内外で活用できる臨床試験データ(科学的エビデンス)を提供することで、製品の差別化やブランド価値向上を後押ししています。「他社と差をつけたい」「科学的裏付けをもって訴求したい」といった企業の悩みに応えてくれるでしょう。
-
株式会社EAS公式サイト
https://eas-ct.jp/ -
ヒト臨床試験の詳細はこちら
https://eas-ct.jp/#01-id -
試験実施に関するご相談・お見積もりのご依頼はこちら
https://eas-ct.jp/contact/